Imagens

História clínica
Paciente do sexo feminino, com 17 anos, apresentava quadro de cefaleia, recorrente há 1 ano, progredindo em intensidade e frequência, além de vômito e tontura. A ressonância magnética indicava uma massa expansiva em corno posterior esquerdo do ventrículo lateral, levando a compressão e edema vasogênico na substância branca adjacente. A lesão apresentava limites bem definidos, contornos lobulados e medindo 3,8 x 2,6 x 2,7 cm. Foi realizada craniotomia parieto-occipital esquerda com ressecção de tumor. No ato operatório, evidenciava-se edema cerebral importante e lesão extensamente vascularizada, com sangramento persistente.
Imagens
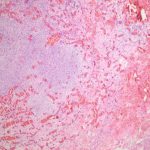
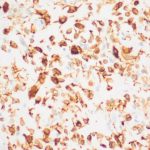
- 1. HE, objetiva de 40 X – Área da lesão rica em vasos. Cortesia do Dr. Gustavo Teixeira, patologista do Hospital de Amor de Barretos.
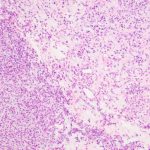
- 2. HE, objetiva de 100X – Área da lesão demonstrando transição do estroma mais denso para área mais frouxa. Cortesia do Dr. Gustavo Teixeira, patologista do Hospital de Amor de Barretos.
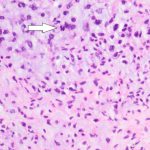
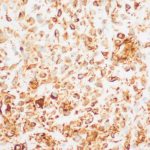
- 3. HE, objetiva de 400X – Área da lesão com fundo mixoide e mitose (seta). Cortesia do Dr. Gustavo Teixeira, patologista do Hospital de Amor de Barretos.
- 4. Desmina, objetiva de 400X – Marcação positiva em padrão citoplasmático. Cortesia do Dr. Gustavo Teixeira, patologista do Hospital de Amor de Barretos.
- 5. Vimentina, objetiva de 400X – Marcação positiva em padrão citoplasmático. Cortesia do Dr. Gustavo Teixeira, patologista do Hospital de Amor de Barretos.
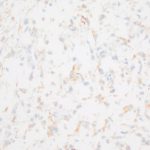
- 6. EMA, objetiva de 400X – Marcação positiva focal em padrão membrana. Cortesia do Dr. Gustavo Teixeira, patologista do Hospital de Amor de Barretos.
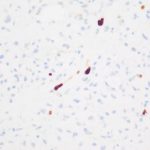
- 7. Ki-67, objetiva de 400X – Demonstrando o baixo índice proliferativo. Cortesia do Dr. Gustavo Teixeira, patologista do Hospital de Amor de Barretos.
Achados morfológicos
Ao exame microscópico, a neoplasia era constituída por células fusiformes, discretamente atípicas, dispostas em um padrão reticular, estroma ora frouxo com fundo mixoide e ora fundo fibrilar desorganizado com as células mais aderidas em conformações micronodulares. Em áreas, visualizava-se proliferação de vasos, preenchidos por hemácias e algum extravasamento intersticial. Não foram evidenciados achados de alto grau histológico na amostra examinada. À avaliação imuno-histoquímica, a lesão apresentava positividade para desmina e vimentina. O EMA apresentava padrão de marcação em raras células. Outros marcadores positivos foram: Ciclina-D1, FLI-1, TLE-1 e o p16. O CD99 foi negativo e o Ki-67 demonstrou um índice proliferativo estimado em 3%. Além destes supracitados, GFAP, OLIG2, NF, SATB2, sinaptofisina, S100, SOX10, MAP2, CD34, ERG, BRAF (DAB), NKX2.2, OCT4, SALL4, CK8/18, NY-ESO-1 e WT-1 foram negativos. O INI-1 manteve imunoexpressão. O resultado da pesquisa de translocação por Sequenciamento de Nova Geração (NGS) resultou na detecção da fusão dos genes EWSR1-CREM.
Seguimento clínico
No pós-operatório imediato, a paciente apresentou afasia nominal, alucinação dolorosa e hemiparesia direita. Permaneceu em seguimento demonstrando gradativa melhora destes sintomas. 4 meses após procedimento, a paciente foi reabordada para ressecção de nodulação na porção lateral da cavitação cirúrgica medindo 1,0 cm correspondendo a remanescente tumoral, demonstrando mesma morfologia observada na primeira lesão. Atualmente, a paciente ainda segue em acompanhamento.
Discussão
Tumores Mesenquimais Intracranianos com Fusão FET-CREB Positiva são um grupo de neoplasias recentemente descritas na população pediátrica e em adultos jovens, mas que podem ocorrer em qualquer idade. São caracterizadas pela fusão de um gene da família FET (EWSR1 e mais raramente FUS) com um fator de transcrição da família CREB (ATF1, CREB1 e mais raramente CREM) (1, 2, 3, 4, 8, 10, 12).
A lesão pode ter grande espectro morfológico. Ela pode ser constituída por células fusiformes, epitelioides ou rabdoides, podendo estar dispostas em cordões, em padrão de crescimento reticular, padrão sincicial, ou até mesmo padrão sólido. A atividade mitótica costuma ser rara (Ki-67< 5%). O tumor tende a localizar-se supratentorialmente, mantendo relação com meninge, aparência lobulada, delimitada, por vezes de aspecto sólido-cístico, podendo apresentar vasculatura dilatada, áreas mixoides e infiltrado inflamatório peritumoral, sem evidência de invasão do parênquima ou necrose. Características adicionais podem incluir a presença de formações em espirais semelhantes ao encontrado em meningiomas ou fibras do tipo amiantoide (4, 6, 7, 10, 12).
A imuno-histoquímica costuma revelar um padrão de positividade recorrente das células neoplásicas para EMA, CD99 e desmina podendo variar esta positividade entre difusa a focal. Existe um amplo espectro de relatos de outros marcadores, sendo entre outros: vimentina, MUC4, S100, CD68 variavelmente positivos (1, 2, 5, 9, 10, 11, 12).
Os achados morfológicos e o perfil imuno-histoquímico do caso foram os mesmos que à época do diagnóstico eram descritos como Tumores Mesenquimais Mixoides Intracranianos com fusões EWSR1-CREB. Neoplasias que se assemelham à variante mixoide do Fibro-histiocitoma Angiomatoide (AFH). Mais recentemente, em consenso pela Classificação de Tumores do Sistema Nervoso Central pela Organização Mundial de Saúde (WHO), ambas as lesões englobariam o diagnóstico provisoriamente estabelecido como: Tumor Mesenquimal Intracraniano com Fusão FET-CREB Positiva. Estes apresentam recorrência, mas raramente metástase ou óbito. Os melhores desfechos encontram-se em relatos com ressecção completa da lesão. Enquanto as possibilidades terapêuticas específicas não surgem, a radioterapia adjuvante, levando em conta a recorrência frequente, permanece como alternativa plausível. Para estabelecer o comportamento biológico destes tumores é essencial a coleta de dados mais robustos para estabelecer prognóstico (10, 11, 12, 13).
Referências bibliográficas
- AGUIAR, P. V. et al. Myxoid mesenchymal intraventricular brain tumour with EWSR1–CREB1 gene fusion in an adult woman. Virchows Archiv. 2021, 478(5), 1019-1024
- BALE, T. A. et al. Intracranial myxoid mesenchymal tumors with EWSR1 -CREB family gene fusions: myxoid variant of angiomatoid fibrous histiocytoma or novel entity? Brain Pathology, 2017, 28(2), 183–191
- BALLESTER, L. Y. et al. Intracranial Myxoid Mesenchymal Tumor With EWSR1-ATF1 Fusion. Journal of Neuropathology & Experimental Neurology, 2020, 79(3), 347-351
- DOMINGO, R. A., et al. Intracranial Myxoid Mesenchymal Tumor/Myxoid Subtype Angiomatous Fibrous Histiocytoma: Diagnostic and Prognostic Challenges. Neurosurgery, 2020, 15, 88(1), E114-E122
- DUNHAM, C. et al. Primary Intracerebral Angiomatoid Fibrous Histiocytoma: Report of a Case With a t(12;22)(q13;q12) Causing Type 1 Fusion of the EWS and ATF-1 Genes. The American Journal of Surgical Pathology, 2008, 32(3), 478–484
- KAO, Y.-C. et al. EWSR1 Fusions With CREB Family Transcription Factors Define a Novel Myxoid Mesenchymal Tumor With Predilection for Intracranial Location. The American Journal of Surgical Pathology, 2017, 41(4), 482–490
- KOMATSU, M. et al Intracranial myxoid mesenchymal tumor with EWSR1–CREB1 gene fusion: a case report and literature review. Brain Tumor Pathology, 2020, 37(2), 76–80
- LIBBRECHT, S. Intracranial myxoid mesenchymal tumor with EWSR1-CREB1 fusion. Pathology – Research and Practice. 2020, 216(12), 153239
- SCHAEFER, I. M.; FLETCHER, C. D. M. Myxoid Variant of So-called Angiomatoid “Malignant Fibrous Histiocytoma.” The American Journal of Surgical Pathology, 2014, 38(6), 816–823
- SLOAN, E. A. et al. Intracranial mesenchymal tumor with FET-CREB fusion – A unifying diagnosis for the spectrum of intracranial myxoid mesenchymal tumors and angiomatoid fibrous histiocytoma-like neoplasms. Brain Pathol. 2021, 31(4), e12918
- WHITE, M. D. et al. Intracranial Myxoid Mesenchymal Tumor with Rare EWSR1-CREM Translocation. Pediatric Neurosurgery, 2019, 54(5), 347–353
- WHO Classification of Tumours Editorial Board. World Health Organization Classification of Tumours of the Central Nervous System. 5th ed. Lyon: International Agency for Research on Cancer; 2021
- YOSHIDA, A. et al. Expanding the Phenotypic Spectrum of Mesenchymal Tumors Harboring the EWSR1-CREM Fusion. The American Journal of Surgical Pathology. 2019, 43 (12), 1622-1630








 Bourbon Resort Cataratas do Iguaçu
Bourbon Resort Cataratas do Iguaçu Av. das Cataratas, 2345 - Vila Yolanda,
Av. das Cataratas, 2345 - Vila Yolanda,